流れ 2014年12月号 目次
― 特集テーマ:2014年度年次大会 (2) ―
| リンク一覧にもどる | |
プロセス・トモグラフィー法による血液循環流路内の血栓検出の可能性
Sapkota Achyut
布施 拓士
丸山 修
武居 昌宏
|
1. はじめに
現在,日本人の死因の約30%を循環器系疾患(心疾患,脳血管疾患)が占める.これらの治療には移植に対する倫理問題や,慢性的なドナー不足といったことから,人工心臓,人工弁,人工血管などの人工臓器が実用化されてきた(1).ここで,人工臓器を用いることによる血栓症のリスク増大が新たな問題となった.血栓症のリスクを軽減するために,定期的な抗凝固薬の投与を行っているが,副作用などにより患者の負担が増大している.そこで,抗凝固薬の投与を最適化する必要があり,そのためには血液循環流路内で,”いつ”,”どこで”,”どれだけ”の血栓が通過したかを計測するオンライン微小血栓可視化計測方法が必要不可欠である.
そこで,著者らは,図1に示す通り,プロセス・トモグラフィー(PT)法(2,3)を血液循環流路内に設置し,血栓の通過時間“いつ”,血栓の通過位置“どこで”,および,量“どれだけ”をオンラインで計測できる微小血栓可視化計測方法を開発している.この方法は,血液に交流電流を印加し,交流周波数を掃引して周波数ごとに抵抗率,および,誘電率などの電気物理量を計測することで,血漿などの媒質や赤血球の成分ごとの変化から,微小血栓形成をとらえることができる方法である(2,3,4).
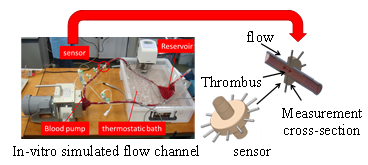
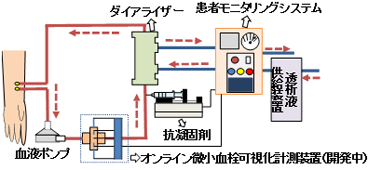
Fig. 1 Final goal
2 PT法の計測原理
PT法とは図2に示す通り,電極を流路外周に多数配置させ電気量を計測し,画像再構成アルゴリズムにより,混相流における濃度分布や異物の有無を可視化する方法である(2).具体的には,図2に示す通り,まず,既知の値から順問題を解くことで感度関数(ヤコビ行列)Jを求め,次に,ある2電極間に交流電流を印加し,その周りのペアの電圧Uを計測する.そして,その計測結果から,式(1)を逆問題として解き,ρの分布を得て,断面の電気量の分布の画像を再構成する方法である.
| (1) |
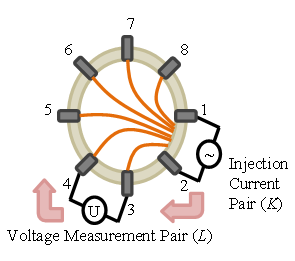
(a) Electrode arrangement
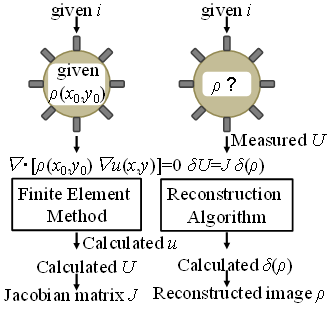
(b) Imaging algorithm
Fig. 2 Measurement principle of the PT method
3 “いつ”, “どこで”, “どれだけ”の血栓通過
3.1 “いつ”, “どこで”の血栓通過
図3(a)は実験装置の一例であり,図3(a)のCase.1に示す通り,ウシ血液を充填した測定容器に3 mmおよび5 mmの大きさの血栓を沈降させ,PT法により断面の抵抗率分布を求めた.図3(b)は血栓通過時“いつ”の断面の抵抗率分布の時間変化を示したものである.図の赤い部分は抵抗率が高い位置で,青い部分は抵抗率が低い位置である.t=83.0sで抵抗率の高い位置が確認でき,t=84.0sで明らかに高い位置が出現し,t=86.0sまでその高い位置が確認できる.さらに,図3(c)に示す通り,血栓の空間的位置を変えて実験を行い,画像再構成したところ,実際の血栓位置“どこで”と画像再構成によって推測される血栓位置が一致することを確認できた.
また,図3(a)のCase.2に示す通り,測定容器内にウシ血液を充填した後,塩化カルシウム水溶液(CaCl2)を添加することで,血栓形成時間“いつ”と血栓形成位置“どこで”の検出を検討する実験を行った(4,5).図3(d)は実験結果であり,血栓形成過程は無血栓状態の相対抵抗率とは異なる時間変化を示し,t=9[min]において,血栓形成が確認できた.また,その後の血栓の量が増えていることも検出することができた.
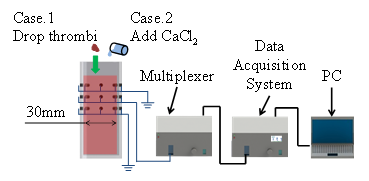
(a) Experimental setup
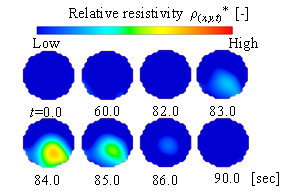
(b) Resistivity tomogram of settling thrombus
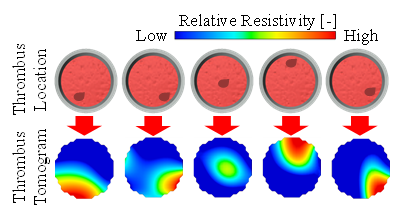
(c) Resistivity tomogram of thrombi at various cross-sectional position
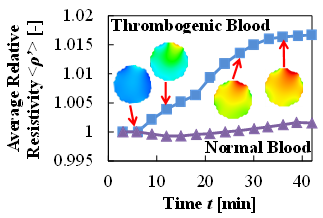
(d) Temporal change of relative resistivity in case of thrombogenic and normal blood
Fig. 3 Thrombi visualization using PT method
3.2 “どれだけ”の検出の評価:
一方,血栓量によって抵抗率の増加範囲が増えることは確認できたが,現在のPT画像の解像度が比較的低いため“どれだけ”を定量的かつ正確に計測することが可能であるかということが最大の課題となる.そこで,血栓量“どれだけ”による血栓の電気的特性を評価する.
血栓量と血栓密度の観点から,血栓量“どれだけ”の検出を検討する実験を行った(6).血栓量の実験は,表1に示す通り,測定容器内に予め形成した様々な大きさの血栓とウシ血液を充填した.また,血栓密度の実験は,表2に示す通り,血栓量を一定とし,血栓と血液のヘマトクリットを変化させて行った.どちらの実験においても,全体(形成した血栓と充填したウシ血液の合計)の赤血球量は一定とした.図4(a)~(d)は実験結果を示しており,血栓量,血栓密度のどちらの場合においても抵抗率では大きな差が確認できず,比誘電率では線形的に増加することが確認できた.
Table 1 Experiment samples with the thrombi prepared from varied volume of blood
|
Thrombus Volume |
Blood Volume |
PBS Volume |
Total Volume |
Sample V1 |
0.0 |
3.5 |
0.5 |
4.0 |
Sample V2 |
1.5 |
2.5 |
0 |
4.0 |
Sample V3 |
2.5 |
1.5 |
0 |
4.0 |
Sample V4 |
3.5 |
0.5 |
0 |
4.0 |
Table 2 Experiment samples with the thrombi prepared from varied volume of blood
|
Thrombus Hematocrit |
Blood Hematocrit |
Total Hematocrit |
Sample D1 |
PBS |
40 |
40 |
Sample D2 |
20 |
48 |
40 |
Sample D3 |
30 |
44 |
40 |
Sample D4 |
40 |
40 |
40 |
Sample D5 |
50 |
36 |
40 |
Sample D6 |
60 |
32 |
40 |
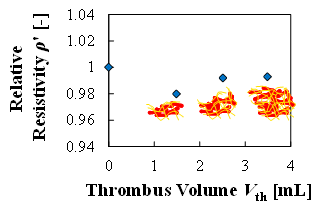
(a) Change in relative resistivity with the increase in volume of the thrombi
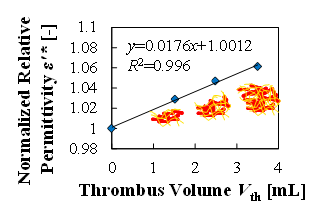
(b) Change in relative permittivity with the increase in volume of the thrombi
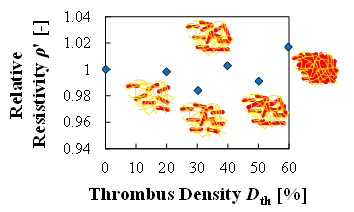
(c) Change in relative resistivity with the increase in hematocrit at fixed volume thrombi
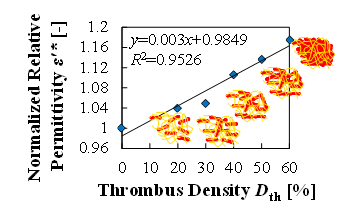
(d) Change in relative permittivity with the increase in hematocrit at fixed volume thrombi
Fig. 4 Evaluation of change of resistivity and permittivity with the change in volume and hematocrit of thrombi
図5(a)は血栓量をパラメータとした実験において,全測定周波数における,血栓量増加に対する抵抗率の増加の線形性を示す.図に示す通り,抵抗率においては線形性が確認されなかった.また,図5(b)は血栓量をパラメータとした実験において,全測定周波数における,血栓量増加に対する比誘電率の増加の線形性を示す.図に示す通り,比誘電率においては100kHzから1MHzにおいて線形性(R2>0.9)が確認された.
図5(c)は,様々なヘマトクリットのウシ血液の電気特性を計測した結果である(7).この結果から,100kHzから1MHzの周波数帯で赤血球の特性を表していることがわかる(7,8).したがって,この周波数帯での誘電率を計測することによって,血栓の量“どれだけ”をより正確に検出することができた.
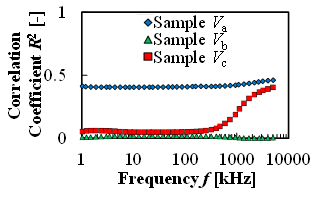
(a) Correlation of Linear dependency of resistivity and thrombi volume at various AC frequencies
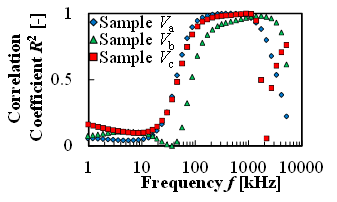
(b) Correlation of Linear dependency of permittivity and thrombi volume at various AC frequencies
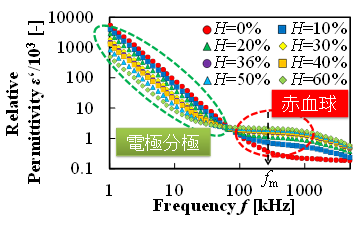
(c) Relative permittivity of blood at various frequencies and hematocrit values
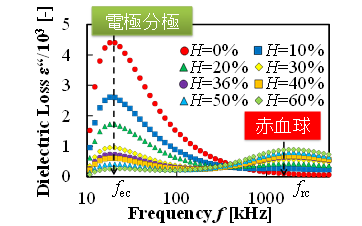
(d) Dielectric loss of blood at various frequencies and hematocrit values
Fig. 5 Frequency dependency of the electrical parameters of blood and thrombi
4. 終わりに
PT法を用いて,血栓の通過時間“いつ”,通過する位置“どこで”,および,量“どれだけ”の検出実験を行なった結果,血液中の血栓の通過時間,位置,および,量に対して,抵抗率および比誘電率は線形的に増加した.これらの結果から,血栓の電気的特性を利用し,オンラインで微小血栓を検出できる可視化計測方法の開発が可能である.
謝 辞
本研究の一部は,千葉大学ベンチャービジネスラボラトリー研究プロジェクト,千葉大学COEスタートアッププログラム,科学研究費挑戦的萌芽研究 (26630046),科学研究費若手研究B (26750143),(一社)日本人工臓器学会Yoshimi T.M.P Grant,JST・A-STEP探索タイプ (AS232Z00121F),(一財)双葉電子記念財団,(一財)テルモ科学技術振興財団,アジレントテクノロジー(株)ACT-URプログラムの研究助成金によってなされました.皆様に厚く御礼申し上げます.
文 献
| (1) | T.Yamane, “The present and future state of nonpulsatile artificial heart technology”, Journal of Artificial Organs, Vol. 5, No. 3 (2000), pp. 149-155 |
| (2) | M. Takei and N. T. A. Othman, “The application of tomography in Microreactors”, Industrial tomography: Systems and applications; Chapter 33, Editor Mi Wang, Woodhead Publishing (2014) (in Press) |
| (3) | 武居昌宏,山根隆志,赤血球モニター及び赤血球のモニタリング方法, 特開 2012-052944 |
| (4) | 朝倉悠太, サプコタ・アチュタ, 丸山修, 小阪亮, 山根隆志, 武居昌宏, “プロセス・トモグラフィー法による静止血液中の沈降血栓の時間空間可視化計測”, 可視化情報学会論文集, Vol. 33, No. 10 (2013), pp. 17-24 |
| (5) | A.Sapkota, Y.Asakura, O.Maruyama, R.Kosaka, T.Yamane, M.Takei, “Risk analysis and detection of thrombosis by measurement of electrical resistivity of blood”, Proc. 35th Annual International Conference of the IEEE Engineering in Medicine and Biology Society, 2013, pp. 4086-4089 |
| (6) | T.Fuse, A.Sapkota, O.Maruyama, R.Kosaka, T.Yamane and M.Takei, “Quantitative analysis of the thrombus using electrical measurement”, Journal of Biorheology (2014) (in Press) |
| (7) | 朝倉悠太, サプコタ・アチュタ, 丸山修, 小阪亮, 山根隆志, 武居昌宏, “誘電緩和法によるヘマトクリットをパラメータとした赤血球の特性周波数と血栓形成過程の計測”, 日本機械学会論文集, Vol.80, No.816 (2014), BMS0245 |
| (8) | 花井哲也, “不均質構造と誘電率”, 吉岡書店 (2000), pp. 61-78 |





