流れ 2016年2月号 目次
― 特集テーマ:流体工学部門講演会 ―
| リンク一覧にもどる | |
人工心臓に活きる流体工学
山根 隆志
|
1.人工心臓の歴史的動向(1,2)
厚生労働省人口動態統計によれば、わが国の死亡者数のうち、心臓・脳・血管疾患が30万人を超える。そのうち重症心疾患の患者として、心臓移植希望登録者が450人おり、家族同意を認めた法改正により移植ドナーが年平均6人から年平均40人に増えても、なお410人分の心臓が不足している。これを補う医療は、人工心臓か再生医療しかなく、緊急に治療を必要とする場合は、人工心臓以外に方法は無い。
人工心臓の歴史は、血栓と感染を克服する歴史であった。臨床応用をめざす研究は、1957年米国でオランダ人W.Kolff博士と日本人T.Akutsu博士の動物実験から始まった。心臓を切除する全置換拍動型(TAH)から始まったが、その後手技が変わり、生体心臓を残して装着する補助人工心臓(VAD)が主流となった。
抗血栓性材料としてポリウレタンが登場したことにより、1981年から拍動型人工心臓の臨床試験が始まった。1987年からは感染症防止に有効で退院可能な、腹腔埋め込み拍動型(第1世代、図1)が使用され始めたが、重量は1400gを超えていた。
1998年より、回転型の補助人工心臓が導入され、小型化・埋込み型の技術革新が進み、退院が可能となった。機械接触軸受を採用した主に軸流型であり、第2世代と呼ばれる。1998年よりすでに22,000症例を超えて使用されている。重量が200~500gと小型で埋め込みが容易なことと、部分点数が少ないため信頼性が向上した。
回転型にさらに超高耐久性の非接触軸受が採用されたことにより、長期使用が可能となった。これが第3世代である。磁気軸受を使用したVAD(テルモ社DuraHeart)、メカニカルシールを使用したVAD(サンメディカル技術研究所EVAHEART)、さらに流体動圧軸受を使用したVAD(HeartWare社HVAD、NEDO軸流VAD)などがある。
第2世代および第3世代の補助人工心臓は、退院・就業復帰できる点が特徴で、携帯型バッテリは8~10時間使用できシャワーも使える。海外での新規埋め込みは、ほとんど全てこの回転型(連続流型)VADになっている。
このように製品が出揃ったが、最近、長期人工心臓までのつなぎ(Bridge-to-bridge)として、磁気軸受遠心式(Thoratec社CentriMag)や、耐久性のある遠心式体外循環(RotaFlow、産総研が開発協力したメラ遠心ポンプ)もでき、数日を超えて呼吸・循環補助に使用できる可能性が開けている(3,4)。
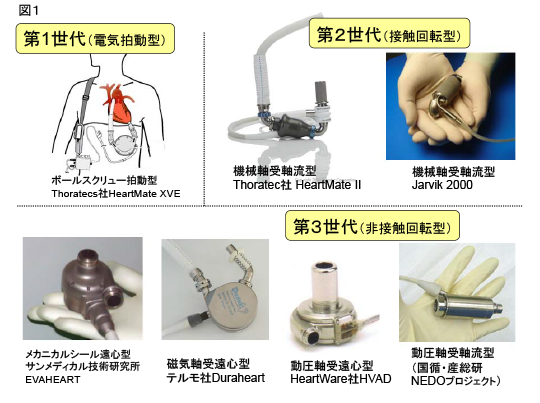
図1 人工心臓の種類(第一世代から第三世代へ)
2.人工心臓ポンプの種類と軸受の種類
人工心臓に使えるポンプ形式は大きく分けて、
(1)弁がある拍動容積型【機能は拍動流ポンプ】
(2)仕切弁が回転する回転容積型
(3)弁がない回転速度型【機能は連続流ポンプ】
にグルーピングされる。回転速度型には遠心ポンプや軸流ポンプなどがあり、VADの主流となっている。回転容積型には、チューブをしごく形式のローラーポンプも手術用として使用されているが装置は大型である。
第2世代の補助人工心臓は回転速度型で機械式軸受を採用しており、ポンプの多くはシールレス軸流ポンプであるが、ダブルピボットで羽根車を支持する形式が多い。一定回転で使用するため脈が無くなるのではという懸念が、かつてあったが、心臓と並列に補助人工心臓を装着することにより、ポンプ発生圧力が一定であっても、循環抵抗の変化に応じて血流量が拍動流となることが臨床的に確認され、無拍動となる心配は無いことが使用上の信頼感をもたらしている。
第3世代の長期植込みにたえる超高耐久性の軸受としては、磁気軸受と流体動圧軸受がある(図2)。磁気軸受は位置センサによりインペラ位置を検出して、電磁石で一定位置に能動制御するものであり、隙間200μm以上を維持することが可能である。一方、流体動圧軸受の原理は、狭いくさび形隙間ないしステップ形隙間に入り込む流体が、潤滑理論により複数点で局所圧を発生して隙間を押し広げるものである。センサレスで動作する点が長所であるが、多くは永久磁石の磁気バランスと組合せて構成されている。なおサブミクロン厚さの液膜で血液と冷却水の混合を遮断するメカニカルシールを採用したものもある。
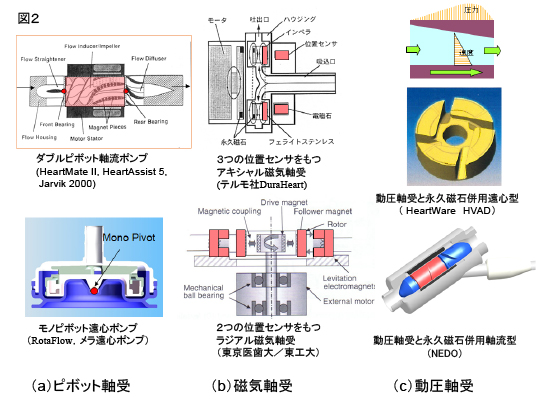
図2 軸受の種類
3.血液適合性の向上
人工心臓の開発における血液適合性の主な課題は、溶血と血栓の防止である。
血球破壊(溶血)は赤血球膜が破れてヘモグロビンが血漿中にもれ出て、いわゆる血尿状態になることである。血球破壊への影響因子は、せん断応力と暴露時間といわれており、せん断流中で赤血球膜が疲労破壊する現象と理解されている。なお暴露時間(T)は、逆数を取れば流速(L/T)で評価することもできる。溶血許容限度は、せん断速度7万~30万 s-1に対応するとした別々の研究があるが、数倍の範囲に収まっていることは、興味深い。10万 s-1が産総研での経験値である。
一方、血液凝固は血液の異物反応であり、原因は大きく3つに、フィブリン網が形成される凝固系、偽足が伸びる血小板系、免疫系の白血球などによる補体系に分類され、相互に絡んで凝集が発生する。抗血栓性材料の開発が行われ、回転型には純チタンやチタン合金が使用されており、MPCポリマーなどコーティング技術も発達した。レオメーを使った血液凝固実験により、凝固は100 s-1以下で起きるとした橋本らの研究がある。動物実験と可視化実験の比較から300 s-1 以下が赤色血栓、1700 s-1以下が白色血栓とした産総研の研究例もある。
最近は、溶血と血栓以外に、補助人工心臓によるvon Willebrand 因子の損傷が、消化管出血(VWF症候群)を引き起こすのではないか、といわれて話題になっている。
4.おわりに
人工心臓の技術開発には材料や流体といった機械工学が大きく貢献してきた。さらに開発者と医師と行政官が協力しあわなければ、製品化には辿りつけなかったことも事実である(5,6)。異なる分野、異なる立場の人々が協力して、はじめて医療機器が実現化できることを歴史は示している。
文献


